Эксперты рассказали о преимуществах математического моделирования при разработке дженериков

«Краш-тест» для фармы
Последние несколько лет заставили по-другому взглянуть на вопросы лекарственного суверенитета России. Сначала пандемия в 2020 году, а затем беспрецедентные санкции в 2022-м. Провели «краш-тест» отечественной фармацевтической индустрии, выявивший ряд системных проблем. И их необходимо решать как можно быстрее, чтобы вопросы дефицита лекарств не стали массовыми. Особенно остро стоит вопрос замены препаратов, поставляемых в Россию компаниями из недружественных стран [1].
Правительство РФ принимает активные меры по развитию фармацевтической отрасли. В сентябре 2022 года зам. министра здравоохранения Сергей Глаголев сообщил, что Минздрав и Министерство промышленности и торговли поручили российским предприятиям оперативно разработать отечественные аналоги 189 зарубежных препаратов для терапии редких заболеваний [2]. Российские регионы активно развивают практику офсетных контрактов с фармацевтическими компаниями, позволяющую создавать новые площадки для разработки и производства препаратов [3]. Хотя создание и вывод на рынок аналогов существующих препаратов не так технологически сложны, как разработка инновационных лекарств, но все же это длительный процесс, скрывающий немало подводных камней.
Процесс разработки
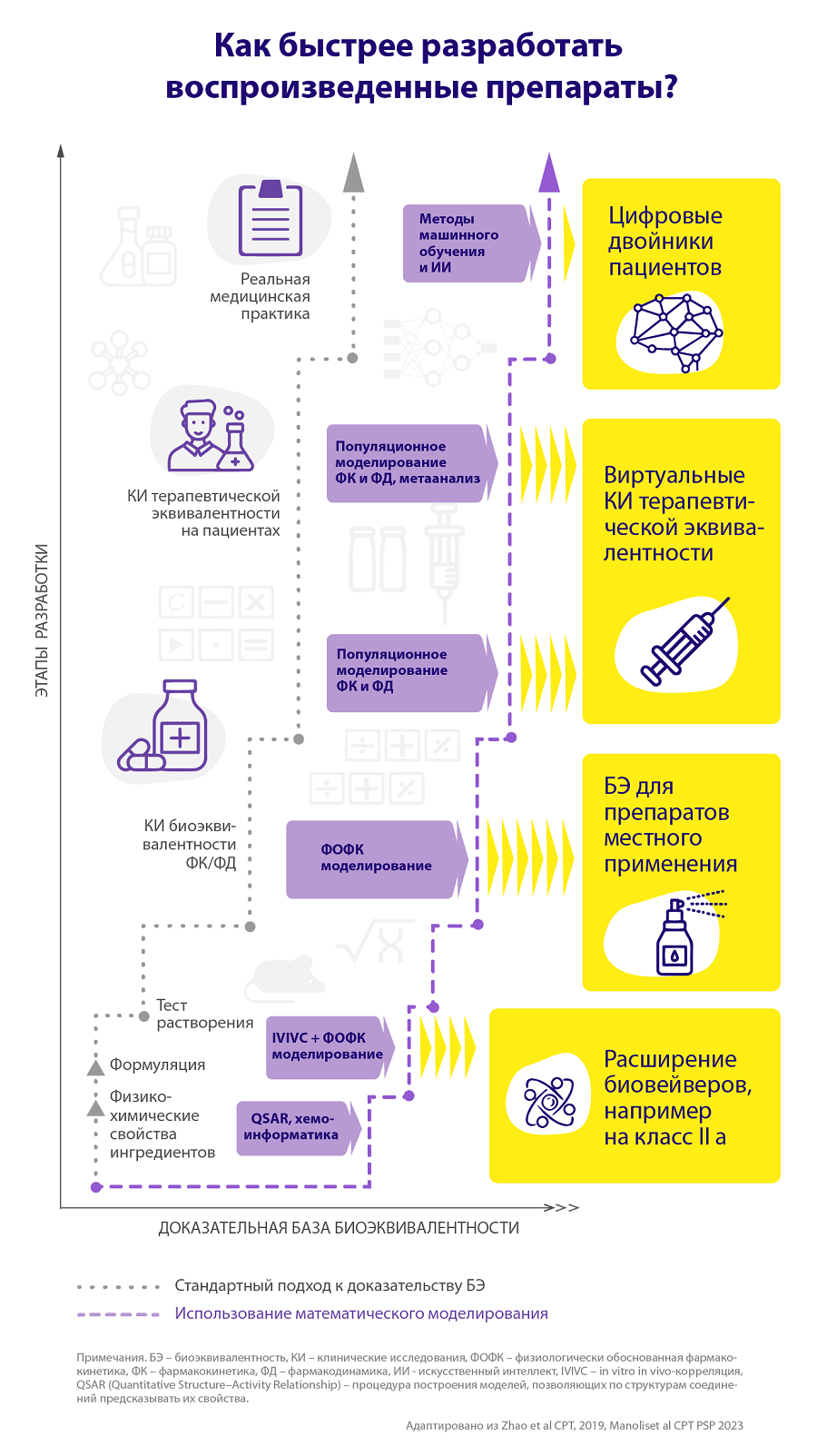
Что нужно для успешного вывода на рынок нового дженерика или биоаналога? С научной и регуляторной точки зрения главная проблема здесь — доказательство биоэквивалентности (БЭ), надо доказать, что между новым препаратом и зарегистрированным аналогом не существует значимых различий. Однако объем необходимой доказательной базы может существенно отличаться в зависимости от типа препарата, и это влияет на время его вывода на рынок [4].
Обычно разработка воспроизведенного препарата, как и оригинального, начинается с исследований in vitro, когда (например, за счет теста сравнительной кинетики растворения) дженерик признается фармацевтически эквивалентным оригинальному препарату. К сожалению, далеко не все фармацевтически эквивалентные субстанции способны вести себя одинаково у людей. Поэтому необходимы исследования in vivo, первый этап которых проходит на здоровых добровольцах и не занимает много времени. Как правило, в таких исследованиях участвуют несколько десятков человек, а для завершения их хватит нескольких недель.
Однако и таких данных может быть недостаточно для доказательства БЭ значительного числа препаратов. В этом случае возникает необходимость провести клиническое исследование терапевтической эквивалентности с полным воспроизведением режима приема лекарства. Пациентов в таких исследованиях всегда больше, чем на предыдущем этапе, а по времени испытания могут занимать до нескольких месяцев и даже лет. Таким образом, если нужно проводить полный цикл исследований, разработка дженерика или биоаналога может занять до двух-трех лет.
Быстрее не значит хуже
Можно ли упростить и тем самым ускорить процесс вывода дженериков на рынок? На этом пути существуют сложности. Как и при разработке инновационных препаратов, необходимо найти достоверные ответы на определенные вопросы, прежде чем перейти к следующей фазе исследований или обоснованно от нее отказаться. Например, только для хорошо растворимых и проникающих через слизистую кишечника веществ I и III класса биофармацевтической классификационной системы (БКС) можно использовать процедуру биовейвера: без ущерба для доказательства биоэквивалентности отказаться от проведения клинических исследований на основе данных in vitro по кинетике растворения [5]. Однако для большинства малых молекул и биопрепаратов проблемы с интерпретацией доказательств могут возникать и при проведении клинических исследований, например, из-за высокого разброса результатов или узкого терапевтического окна воспроизводимой терапии.
Если обратиться к процессу разработки инновационных лекарств, где таких реперных точек несравнимо больше, чем при разработке дженериков, можно заметить, что наиболее универсальный способ увеличения доказательной силы клинических исследований — применение продвинутых методов статистического анализа, таких как математическое моделирование и фармакометрика [6]. В последние несколько лет западные регуляторы — как американский FDA (Food and Drug Administration) [7], так и европейский EMA (European Medicines Agency) [8] — активно используют фармакометрические методы при регистрации именно дженериков и биоаналогов.
«Отечественная фарминдустрия сейчас находится в уникальной точке, — заявил директор компании «M&S Decisions» Кирилл Песков. — С учетом колоссальных задач, стоящих перед отраслью, мы можем выбирать: идти ли по пути упрощения далее или, используя наиболее передовые методы и технологии, создать полноценную научно-технологическую вертикаль в разработке лекарств. В России собрана уникальная экспертиза по математическому моделированию, ее грамотное использование способно осуществить подобный задел. В чем-то мы даже опережаем западные страны и компании, поэтому надо активнее внедрять практику фармакометрического моделирования».
Предиктивная физиология
Один из методов, способных существенно повысить доказательную силу на ранних этапах разработки воспроизведенных препаратов, — физиологически обоснованное фармакокинетическое (ФОФК) моделирование [9]. Эта достаточно сложная и продвинутая методика моделирования позволяет в деталях описать все, что происходит с препаратом с точки зрения фармакокинетики, — то есть, как лекарство циркулирует по организму.
Такие методики широко используются в разработке оригинальных препаратов, иногда позволяя сократить ряд клинико-фармакологических исследований. При доказательстве биоэквивалентности ФОФК-модели могут расширить спектр применения биовейверов на вещества класса IIa по БКС или увеличить допустимые различия результатов теста растворимости [8]. Кроме того, ФОФК-модели могут существенно упростить процедуру доказательства биоэквивалентности для средств местного действия, например в дерматологии или пульмонологии [10].
Роман Иванов, проректор по научно-технологическому развитию, директор научного центра трансляционной медицины НТУ «Сириус»:
«Такие инструменты как физиологически обоснованное фармакокинетическое моделирование являются действительно критически важными для разработчиков лекарственных препаратов. Чтобы восполнить дефицит компетенций в этой области, в Университете «Сириус» при непосредственном участии специалистов компании «M&S Decisions» запущена программа магистратуры по математическому моделированию в разработке лекарственных средств».
Популяционный подход
Для инновационных препаратов популяционный подход является золотым стандартом обработки данных фармакокинетики (ФК) и фармакодинамики (ФД), позволяя, например, значительно повысить точность определения оптимальной дозы активного вещества в инструкции по применению. Внедрение этого метода в анализ клинических исследований биоэквивалентности воспроизведенных лекарств также позволит существенно повысить точность определения фармакологических конечных точек, что может быть критически важно для доказательства БЭ препаратов, для которых сложно проводить множественные измерения ФК [11].
Другой тип воспроизведенных препаратов, где модели могут существенно повысить уровень доказательной базы, — лекарства с узким терапевтическим окном, то есть те, у которых используемые дозировки тесно граничат с интервалом потенциальной токсичности. Эта ситуация достаточно часто встречается для многих антикоагулянтов или иммунодепрессантов в трансплантологии. Очевидно, что к разработке подобных дженериков нужно относиться особенно осторожно, а к вопросу доказательства БЭ — максимально тщательно [12].
Виртуальные исследования БЭ
Во времена бурного развития искусственного интеллекта вопросы проведения виртуальных, то есть полностью компьютерных, исследований вместо клинических вызывают много споров. Тем не менее при создании инновационных препаратов такая практика уже прочно вошла в арсенал разработчиков и не вызывает отторжение у регуляторов. Все дело в качестве моделей, используемых для виртуальных исследований, и в их научной обоснованности [8].
С точки зрения доказательства биоэквивалентности воспроизведенного препарата ключевым способом сократить время его вывода на рынок может быть использование виртуального исследования терапевтической эквивалентности. Для проведения подобных исследований вполне достаточно популяционных моделей ФК и ФД, разработанных на данных, полученных на добровольцах. При внедрении такого подхода, по аналогии с механизмом ускоренной регистрации, последующее клиническое исследование может быть проведено дополнительно, но уже после вывода препарата на рынок, что существенно упростит доступ пациентов к необходимому препарату, но при этом никак не навредит общей доказательной базе [6].
Первые шаги
Почему подобные подходы к разработке дженериков и биоаналогов не внедрены до сих пор в отечественных фармкомпаниях? Существуют объективные факторы, поэтому возникает вопрос о ряде мер, способных помочь российскому бизнесу действовать в этом направлении.
Во-первых, несмотря на то, что в рамках Евразийского экономического союза уже есть документ, закрепляющий правила проведения исследований БЭ (Решение Совета ЕЭК от 3 ноября 2016 года № 85 [4]), нужно регламентировать четкий порядок использования фармакометрических моделей, чтобы и разработчики, и регулятор понимали, как с ними работать и как учитывать результаты. Такие документы существуют и у европейского, и у американского регулятора, так что их адаптация для российского регуляторного процесса не должна занять много времени.
Во-вторых, необходимо инвестировать в разработку российского программного обеспечения, способного упростить процесс создания математических моделей действия лекарственных средств: нужно обезопасить отечественные фармкомпании от проблем с доступом к лицензиям для ПО из недружественных стран. Такие проекты в стране есть и могут быть быстро и эффективно масштабированы [13].
Помимо создания правового поля важно уделить внимание научной экспертизе, а также подготовке молодых научных сотрудников с гибридным профилем, сочетающих как экспериментальные, так и цифровые навыки. Образовательные программы такого направления уже запущены на базе ПМГУ им. Сеченова и Научно-технического университета «Сириус».
Вадим Тарасов, директор Института трансляционной медицины и биотехнологии, ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России:
«В нашей стране мы имеем хорошо развитую дженериковую фармацевтическую промышленность, которая стремится сделать следующий шаг в развитии и разрабатывает оригинальные препараты. И у нас очень сильное ИТ-направление с великолепными специалистами. Думаю, что пришло время самым активным образом объединить эти компетенции и создавать новые ИТ-технологии для разработки лекарств, которые дадут нам преимущество в конкуренции на международном дженериковом рынке и позволят создавать высококонкурентные лекарственные препараты в более короткие сроки и дешевле, нежели это делают глобальные корпорации. Для этого нужны и специальные грантовые программы поддержки таких решений. Тогда мы получим больше возможностей для экспорта лекарств и развития нашей экономики, научно-технологического и производственного потенциала».
1. https://iz.ru/1457764/aigul-khabibullina/pervyi-element-pochemu-iz-rossiiskikh-aptek-propadaiut-antibiotiki.
2. https://www.interfax.ru/russia/860747.
3. https://pharmvestnik.ru/content/news/R-Farm-vyigral-eshe-odin-ofsetnyi-kontrakt-na-postavku-lekarstv.html.
4. https://docs.cntd.ru/document/565704480.
5. https://pharmacopoeia.ru/prilozhenie-4-trebovaniya-k-biovejveru-osnovannomu-na-biofarmatsevticheskoj-sisteme-klassifikatsii.
6. https://link.springer.com/article/10.1007/s11095-022-03288-w.
7. https://ascpt.onlinelibrary.wiley.com/doi/10.1002/cpt.1282.
8. https://ascpt.onlinelibrary.wiley.com/doi/10.1002/psp4.12906.
9. https://ascpt.onlinelibrary.wiley.com/doi/epdf/10.1002/psp4.12907.
10. https://ascpt.onlinelibrary.wiley.com/doi/10.1002/psp4.12600.
11. https://academic.oup.com/biostatistics/article-abstract/23/1/314/5874612?redirectedFrom=fulltext&login=false.
12. https://ascpt.onlinelibrary.wiley.com/doi/10.1002/cpt.28.
13. https://habr.com/ru/articles/713192.
Материал партнера: M&S Decisions
























